Star Trek Meets Evolution: Die Nobelpreise für Chemie und Physik 2018
Ein bisschen habe ich schon gestutzt bei der Bekanntgabe der diesjährigen Nobelpreise für Chemie und Physik: Hörten sich für mich die prämierten Forschungsgebiete doch eher nach Themen aus den Lebens- und Biowissenschaften an. Die Entwicklung von laserbasierten Werkzeugen für die Erforschung von biologischen Systemen, z.B. mit Hilfe der Optischen Pinzette, in der Physik – das ging so gerade noch, da es sich dabei ja um Methoden der Laserphysik handelt. Aber einen Chemie-Nobelpreis für die gerichtete Evolution von Enzymen und das Phagendisplay von Peptiden und Antikörpern: Wohl eher Molekularbiologie – oder vielleicht doch Biochemie?
Gemeinsam ist beiden Preisen, dass es sich um Forschungen handelt, die konkret für die Verbesserung der Lebensbedingungen von Menschen, z.B. durch die Behandlung von Krankheiten eingesetzt werden können, ganz im Sinne von Nobels Grundanliegen, den Preis denjenigen zu verleihen, die “have conferred the greatest benefit to humankind”.
Wenn man nun diesen Stiftungszweck bedenkt, ist es weniger überraschend, dass die Preise für interdisziplinäre Forschungsansätze in anwendungsnahen Grenzgebieten der Chemie und Physik vergeben wurden. Das spiegelt auch die Entwicklungen in der Wissenschaft mit ihrer immer größer werdenden Interdisziplinarität wieder, spannende Themen machen eben nicht vor Disziplingrenzen halt. (Im Gegenteil, für diese braucht es die Expertise aus verschiedenen Fächern, wie z.B. die Exzellenzcluster der Leibniz Universität Hannover zeigen.)
Worum geht es nun bei den diesjährigen Preisen?
Den Nobelpreis für Physik erhalten Arthur Ashkin, Gérard Mourou und Donna Strickland für ihre revolutionären Beiträge zur Laserphysik als Basis für die Entwicklung von Werkzeugen aus Licht.
Gérard Mourou und Donna Strickland werden ausgezeichnet für „ihre Methode zur Erzeugung hochintensiver ultrakurzer optischer Pulse“ und Arthur Ashkin für „die Optische Pinzette und ihre Anwendung auf biologische Systeme“.
Mit einer so einfach wie elegant anmutenden Idee versuchten Gérard Mourou und Donna Strickland das Problem der Verstärkung von kurzen Laserpulsen zu lösen. Bis in die Achtziger Jahre des letzten Jahrhunderts war der Steigerung der Intensität von Lasern schlichtweg eine Grenze gesetzt, u.a. dadurch, dass sich die Lasermaterialien zu stark erhitzten und sich damit selber zerstörten. Mit dem Ansatz der Chirped Pulse Amplification wird der Laserpuls erst im Laser erzeugt und dann (im Nachgang) verstärkt, indem der ultrakurze Puls zunächst zeitlich stark gestreckt und damit paradoxerweise seine Peakleistung erst einmal reduziert wird. Anschließend kann die Peakleistung dieses niederfrequenten Pulses – ohne dem Lasermaterial zu schaden – verstärkt werden, um danach zurück zu einem ultrakurzen, hochfrequenten Puls gestaucht zu werden, der jetzt eine hohe Spitzenleistung hat.
Ganz so einfach war die Umsetzung der Idee in die Realität dann nicht, aber 1985 konnten Gérard Mourou und Donna Strickland das Ergebnis ihrer Bemühungen veröffentlichen: Compression of amplified chirped optical pulses.
Sie haben damit die Basis für viele neue Entwicklungen in der Laserphysik geschaffen: So wurde der Bau kleinerer und weniger teuerer Laser möglich, die schnell auch in der Medizin Anwendungen fanden, z.B. in der Augenchirurgie (LASIK).
Für die Atom- und Molekülphysik eröffnete die Chirped Pulse Amplification den Weg in die Attosekunden- und Starkfeldphysik und auch der Bau intensitätsstarker Beschleunigeranlagen, die auf dem Prinzip der Laser-Plasma-Beschleunigung (Wakefield-Beschleuniger) beruhen, fußt auf dieser Methode.
Im TIB-Portal lässt sich einiges an Literatur zur Chirped Pulse Amplification finden. Gérard Mourou ist dabei einer der eifrigsten Autoren, wie der Autorenfilter zeigt. Auch die entsprechenden Arbeiten von Donna Strickland lassen sich schnell finden.
Bereits in den Sechzigerjahren – unmittelbar nach Erfindung des Lasers – begann der heute 96 Jahre alte Arthur Ashkin mit Laserlicht zu experimentieren und fand dabei schnell heraus, dass sich mit Hilfe eines Laserstrahl kleinste Partikel einfangen und bewegen lassen, sehr ähnlich zu dem aus Star Trek bekannten Traktorstrahl, der Raumschiffe einfangen und abschleppen kann. In den Folgejahren perfektionierte Ashkin diese Optische Pinzette so weit, dass auch sehr kleine Teilchen, wie Moleküle und sogar Atome von ihr „gegriffen“, manipuliert oder untersucht werden können. Interessanterweise lassen sich mit Optischen Pinzetten z.B. molekulare Motoren und ihre (Bewegungs)Eigenschaften genau beobachten. (Das erinnert an den Nobelpreis für Chemie 2016.)
Unter den im TIB-Portal nachgewiesenen Publikationen von Arthur Ashkin ist u.a. ein früher Review-Artikel zum Forschungsgebiet aus dem Jahr 1970 „Acceleration and Trapping of Particles by Radiation Pressure“ sowie ein später entstandener Überblick zur „History of optical trapping and manipulation of small-neutral particles, atoms and molecules“ – für alle, die sich tiefer in das Thema einarbeiten wollen. Die Optische Pinzette oder „optical tweezers“ ist als Werkzeug so relevant, dass es einige Patente dazu gibt. Einen Film zum Nobelpreis – in den Neunzigerjahren produziert vom IWF Göttingen – ist im TIB AV-Portal zu sehen: „Lasermikrostrahl und optische Pinzette. Physikalische Grundlagen – Anwendung in Zellbiologie und Biotechnologie.“
Der Nobelpreis für Chemie geht an Frances H. Arnold für „die gerichtete Evolution von Enzymen“ sowie an George P. Smith und Sir Gregory P. Winter für „das Phagendisplay von Peptiden und Antikörpern“. Ausgezeichnet werden damit Beiträge zur Nutzung der Kraft der Evolution zum Wohle der Menschheit.
Für mich sind das Bereiche der Chemie, in die ich als Physiko-Chemikerin und Festkörperphysikerin nie einen Fuß hineingesetzt habe. Ich stelle fest, sie sind spannend.
Offenbar haben sich Andere ebenfalls gewundert über die thematische Verortung des diesjährigen Chemie-Nobelpreises, so überschreibt Spiegel-Online eine seiner Meldungen mit „So kam das Bio in die Chemie.“
Allen Irritationen zum Trotz: Dass Frances H. Arnold mit der gerichteten Evolution von Enzymen in der Chemie forscht und sich in dieser Fachcommunity bewegt und sichtbar wird, lässt sich sehr gut an den von ihr für ihre Veröffentlichungen gewählten Publikationsorganen ablesen. Arnolds Publikationen sind nämlich überwiegend in Chemie-nahen Verlagen und zentralen Zeitschriften der Chemie erschienen, so auch 2017 ein Übersichtartikel „Gerichtete Evolution: Wie man neue Chemie zum Leben erweckt“ in der Angewandten Chemie, DIE Zeitschrift der Gesellschaft Deutscher Chemiker, verlegt bei Wiley-VCH. Im Journal of Organic Chemistry der American Chemical Society ist im Juli 2018 ein Sonderheft zu Organic and Biocompatible Transformations in Aqueous Media publiziert worden. Als Gasteditorin hat Arnold am Heft mitgewirkt und das Editorial mit verfasst: „Chemistry Takes a Bath: Reactions in Aqueous Media“. Auch ChemRxiv kann sich rühmen bereits einige Artikel der diesjährigen Nobelpreisträgerin erhalten zu haben. Patentierungswürdig sind die Ergebnisse von Frances H. Arnold außerdem.
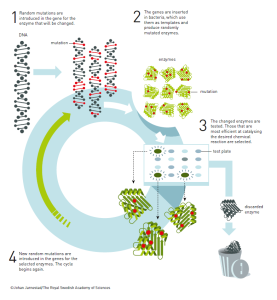
Enzyme sind die Katalysatoren biologischer Systeme. Hatten Chemiker noch vor wenigen Jahren versucht, die funktionellen Gruppen an Enzymen zu identifizieren und diese zur Nutzung zur Katalyse in der Chemie gezielt (chemisch) zu verändert, setzte Arnold auf den evolutionären Zufall. Es stellte sich nämlich heraus, dass der Versuch, die reaktiven Zentren und ihre Funktionsweise zu bestimmen bei den hochkomplexen Enzymen eine anmaßende Herangehensweise war. Was aber gelang, war durch Mutation und Selektion gerichteten Einfluß auf evolutionäre Prozesse zu nehmen und so z.B. Enzyme zu entwickeln, die in einem Lösungsmittel besser arbeiteten, als ihre natürlichen Vorgänger.
Frances H. Arnold hat damit wesentliche Grundlagen einer „Neuen Chemie“ und einer grüneren Chemie gelegt. Ihre für die jeweilige Anwendung maßgeschneiderten Enzyme haben ganz neue Reaktionen und Reaktionswege und damit die gezielte Synthese völlig neuer Substanzen, auch Phamazeutika, ermöglicht.
Neue Wege in der Steuerung von Reaktionen und der Entwicklung neuer Medikamente sind auch George P. Smith und Sir Gregory P. Winter mit ihren Methoden des Phagendisplays von Peptiden und Antikörpern gegangen.
Kern dieser Methode ist, dass Bakteriophagen als Viren der Bakterien die Bakterien bei der Infektion dazu bringen, Kopien des genetischen Materials und der Proteine der Phagekapsel zu produzieren. Schleust man nun ein Gen eines Proteins in die Phagenkapsel ein, dann wird in der Kopie der Phage das zugehörige Peptid als Teil des Kapselproteins auf der Oberfläche der Phage auftauchen. Damit wird quasi angezeigt (Display), von welchem Protein das eingebaute Gen ursprünglich stammt. Das war auch George P. Smiths erstes Anliegen: Für große Molekülbibliotheken mit vielen unbekannten Genschnipseln die zugehörigen Proteine zu identifizieren. Die Phage wird als Link zwischen Proteinen und ihren Genen genutzt. Durch passende Antikörper werden dann die Proteine identifiziert.
Greg Winter ist dann noch einen Schritt weiter gegangen und hat den Gencode von Antikörpern (ebenfalls Proteine) in Phagen eingebaut, so dass die für den Antikörper charakteristische Bindungsstelle an der Phagenoberfläche dargestellt wird. Durch Mutation und Selektion werden diejenigen Antikörper-Phagen vermehrt, deren Antikörpereigenschaften für eine bestimmte Problemstellung durch starke Antikörper-Target-Bindung am geeignetsten erscheinen: Eine gerichtete Evolution von passenden Antikörpern z.B. für die Krebstherapie.
Die Relevanz des Phagendisplays in den Biowisenschaften zeigt sich auf bioRxiv, dem Preprint-Server für die Biologie und auf PubMed Central (hier über 90000 Paper). Im TIB-Portal verteilen sich die knapp 7000 Treffer zu „phage display“ überwiegend auf Quellen der Chemie, Medizin, Technik und Biowissenschaften, darunter auch die Veröffentlichungen von Greg Winter und George P. Smith, wie z.B. einen Review-Artikel von George P. Smith zum „Phage Display“ von 1997. Patente zu Methoden des Phagendisplays lassen sich im TIB-Portal ebenfalls finden.
Heute nun findet die Zeremonie zur Preisverleihung in Stockholm statt und den Geehrten werden ihre Medaille aus den Händen des Schwedischen Königshauses entgegennehmen.
Dafür mussten sie bereits am Samstag die Preisträgervorträge halten, eine gute Möglichkeit für uns, sich aktuelle Forschung von preisgekrönten Forscherinnen und Forschern nahebringen zu lassen.
... ist Fachreferentin für Physik und zuständig für die Nationale Kontaktstelle im Netzwerk arXiv-DH